Сучасні наукові відкриття виглядають так, наче вони походять із фантастичних кінофільмів. Саме так можна схарактеризувати історію, яка почалася в Нідерландах у 1996 році. Тоді молода постдокторантка Граça Рапозу заявила, що клітини її лабораторії взаємодіють одна з одною, надсилаючи секретні повідомлення.
Науковиця досліджувала, як імунні клітини реагують на чужі молекули. Використовуючи електронну мікроскопію, вона помітила, як клітини поглинали молекули, що прилипали до поверхні мініатюрних внутрішньоклітинних пузирів. Потім виділявся “чужорідний” вантаж — його й зафіксувала Рапозу. Інший тип імунної клітини відреагував на них так само - як на чужу молекулу.
Висновок: позаклітинні пузирі — екзосоми - передавали інформацію між клітинами. На той момент вони вже були відомі, але загалом їх вважали лише способом існування клітинного “сміття”. Але Рапозу стверджувала інше: "...деякі з них мають важливі біологічні функції - навіть якщо не всі повірили в них".
Вже через два роки разом зі своїми колегами біологиня, яка зараз працює в Кюрі Інституті в Парижі, виявила, що "екзосоми", отримані з імунних клітин, можуть бути залучені для пригнічення раку у мишей.
Інші вчені зацікавились ідеєю і почали вивчати "екзосоми" з різних типів клітин. Інтерес до них різко зріс після усвідомлення того, що в таких мініатюрних пакетах містяться білки та нуклеїнові кислоти. Вже у 2007 році шведська команда знайшла малі РНК-молекули. А це означає, що "екзосоми" впливають на експресію генів, коли досягають призначених клітин.
Кількість публікацій, присвячених позаклітинним “пузирям”, стрімко зросла, особливо за останні п'ять років.
З часом дослідники встановили більш жорсткі правила того, що вважати "екзосомами". А також визначили критерії ідентифікації цих мініатюрних “пакетиків” в живих системах.
Зараз мікробіологія сконцентрована на вивченні “логістики” переміщень в середині та поза клітинами, а також по іншим складним ландшафтам.
З негативного: досі не зрозуміла їх роль у підтримці здоров'я або у виникненні хвороб. Не виключено, що "екзосоми"можуть, наприклад, відповідати за розповсюдження раку або навіть брати участь у процесі старіння.
Ми тільки знаходимось на початку грандіозних відкриттів. Вчені сподіваються, що "екзосоми" виявляться корисними для діагностики й лікування різних захворювань.
Позаклітинні везикули
У сфері клітинної біології навіть найменші одиниці життя можуть дати глибоке розуміння функціонування нашого організму. Під мікроскопом досить складно спостерігати цілі клітини, не кажучи вже про пошук крихітних частинок, які вони виділяють. Ці мікроскопічні загадки, позаклітинні везикули (ПВ), викликають цікавість вчених з усього світу.
ПВ, крихітні пакети біологічного матеріалу, бувають різних форм і розмірів, а їх походження і функції ставлять дослідників у глухий кут. З роками вчені розділили везикули приблизно на шість великих класів, виходячи з механізмів їх створення. Однак прийнята класифікація не відрізняється особливою точністю, а класи часто перетинаються за розміром і складом, що робить ПВ складними для розрізнення.
Найменший клас, екзосоми, має розмір від 30 до 150 нанометрів. Вони створюються всередині клітин і слугують кур'єрами, які транспортують життєво важливі молекули та частинки до певних місць призначення.
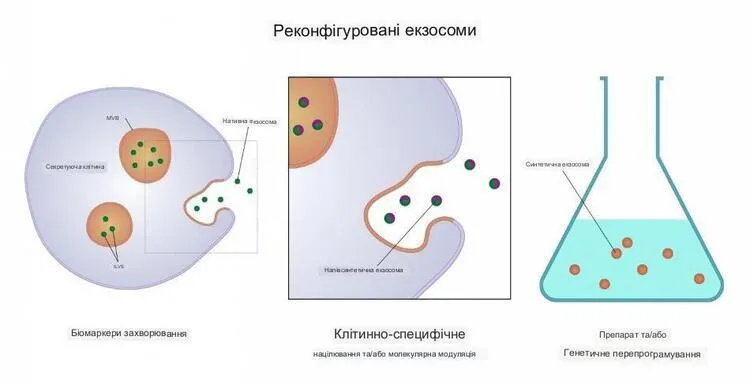
Екзосоми пропонують величезний потенціал як основу для виявлення та лікування захворювань
Вони також укладені в більші пакети, що прямують до клітинної мембрани, зливаються з нею, а потім вивільняють екзосоми в зовнішнє середовище.
На відміну від них, інший клас, ектосоми, можуть похвалитися найширшим діапазоном розмірів, що охоплює від 50 до колосальних 10 000 нанометрів. Ектосоми народжуються шляхом відщеплення від основної мембрани клітини.
Хоча вчені ідентифікували сотні, якщо не тисячі, типів ектосом, їхнє призначення та функції залишаються загадкою. Деякі з них переносять клітинні відходи, переправляючи побічні продукти й токсини до печінки.
Інші вступають у комунікацію або з сусідніми клітинами, або з віддаленими тканинами. Одні спілкуються через поверхневі молекули, а інші доставляють свій вантаж всередину організму. Деякі навіть створюють сприятливе середовище поза клітинами, вивільняючи їхній вміст.
ПВ, що виробляються здоровими клітинами, відіграють життєво важливу роль у регулюванні численних фізіологічних процесів, від запуску імунних реакцій до підтримки клітинного балансу. І навпаки, ПВ хворих клітин можуть сприяти поширенню хвороб. Наприклад, ПВ з ракових клітин містять білки та молекули РНК, що сприяють розвитку раку; вони здатні перенести метастази в інші частини тіла.
Крім того, дослідники підозрюють, що ПВ, які вивільняються нейронами, відповідають за поширення неправильно згорнутих білків, і таким чином загострюється хвороба Альцгеймера, наприклад.
Однак розгадка секретів ПВ не обійшлася без труднощів. Технічні перешкоди у вивченні крихітних і різноманітних частинок призвели до плутанини та розбіжностей у дослідженнях.
Щоб навести лад на цьому "Дикому Заході", науковці розробили стандартизовані методи отримання та найменування ПВ. В результаті вимірювання стали більш узгодженими в різних лабораторіях.
Проте, багато питань про біологію “пакетиків” залишаються без відповіді. Вчені прагнуть зрозуміти, як везикули прокладають свій шлях до клітин-мішеней і чи функціонує їхній вантаж так, як очікується.
Дотепер неясно, чи поводяться ПВ в організмі людини так само як і в культурах клітин. Щоб розв'язати це питання, дослідники мають проаналізувати роботу крихітних месенджерів в цілісному “живому” організмі.
Вивчення позаклітинних везикул залишається динамічною галуззю, що містить потенціал для розгадки тонкощів міжклітинної комунікації та поширення хвороб. Як влучно висловився Ренк Ньовланд з Медичного центра Амстердамського університету: "Я ніколи не бачив переконливих доказів того, що ПВ роблять щось in vivo", підкреслюючи загадкову природу біологічних кур'єрів.
Генетична терапія
Науковці давно мріяли про метод доставки генетичної терапії безпосередньо до заразливих клітин. Мрія стала реальністю якраз завдяки екзосомам (EVs).
Стало зрозуміло, що EVs можуть бути ефективними носіями генетичної інформації, ліків та біологічних молекул, які корегують життєздатність клітини організму. Основна ідея полягає в тому, що мікроскопічні пакетики можна використовувати для боротьби з раковими клітинами, доставки ліків і генетичної терапії на індивідуальному рівні.
Один з відомих дослідників у цій області, Ян Льотвалль з Університету Гетеборга у Швеції, спільно зі своєю командою зазначає: екзосоми можуть транспортувати РНК. Вчені показали, що “пакетики” транспортують генетичну інформацію від однієї імунної клітини до іншої та перетворюють її на біологічно активні білки, принаймні в лабораторних умовах.
Маттью Вуд з Оксфордського Університету відразу побачив потенціал EVs для доставки генетичної терапії. Він багато років намагався розробити методи лікування спадкових генетичних захворювань. Читаючи роботу Льотвалля, Вуд усвідомив, що EVs - ключ до доставки генетичної терапії до потрібних клітин. Він вважає, що, якщо їх правильно змодифікувати, то вони зможуть бути чудовими векторами генетичної терапії.
Науковець витратив чотири роки, щоб довести, що EVs спроєктовані для доставки функціонального генетичного матеріалу до цільових клітин.
Він працював з місформованими білками хвороби Альцгеймера. Він ізолював EVs від певного типу імунної клітини мишей, спроєктував їх для спрямування на нейрони та завантажив у них малий РНК, який вимикає фермент-провокатор хвороби. І добився результату: рівень ферменту зменшився на дві третини. Вдала генетична терапія для мишей.
У 2021 році він та його колеги створили EVs, які здатні переносити та доставляти корисні білки та використовували їх для піддавання умовного запалення, що призводить до слабкості скелетних м'язів в моделі мишей з м'язовою дистрофією Дюшенна.
Зараз багато компаній розробляють системи EV для доставки генетичної терапії для різних захворювань. Технологія стала ще більш вдосконаленою - EVs можуть переносити різні молекули, виражати нові гени, приглушувати їх або навіть редагувати генний матеріал.
Але стандартизовану медичну технологію на основі генетичної терапії з використанням EVs дотепер не було зареєстровано. Коли проведуть клінічні випробування - невідомо.
Водночас деякі науковці вивчають можливість використання EVs для доставки інших типів молекул. Наприклад, китайські вчені завантажують ними хімієтерапевтичні препарати, - метотрексат або цисплатин. Також тривають маленькі випробування, пов’язані з лікуванням окремих видів раку.
Але конкретні методи лікування вимагають певний тип EV. Проте для терапій більшість дослідників створюють їх з використанням стовбурових клітин. В принципі, стандартний підхід для кардіоваскулярних, нейрологічних, імунних та інших розладів.
Спочатку вчені вважали, що лікувальна сила мезенхімальних стовбурових клітин полягає в їхньому потенціалі диференціації в різні типи клітин. Але в 2010 році Сай Кіанг Лім з Інституту молекулярної і клітинної біології A*STAR в Сінгапурі та її колеги показали, що ці клітини випускають особливо маленькі EVs, що переносять деякі властивості.
До того ж EVs мають важливі переваги перед використанням цілих стовбурових клітин для лікування. Клітини можуть реплікуватися і несуть малий ризик вторинного поширення або диференціації в клітини з імунною реакцією. EVs уникають цих ризиків, а нові різновиди проходять випробування на ранніх етапах клінічних випробувань для різних розладів, включаючи інфаркт міокарда та шкірні захворювання.
Екзосоми: мікроскопічні пакетики, що можуть революціонізувати генетичну терапію
Різні EVs, включаючи ті, що виділяються хворими клітинами, мають свій унікальний "підпис" у вигляді різних молекул, таких як білки, РНК та ліпіди. Ці "підписи" виступають у ролі біомаркерів, допомагаючи вченим виявляти захворювання на ранній стадії. Багато компаній вже розробляють діагностичні тести на основі EVs для різних розладів, особливо для тих, де раннє виявлення може покращити прогноз.
У 2019 році з’явився перший в історії діагностичний тест на основі EVs - тест сечі для виявлення раку передміхурової залози, розроблений біотехнологічною компанією Exosome Diagnostics з Волтгема, Массачусетс.
Інша компанія, Exosome Sciences з Сан-Дієго, Каліфорнія, розробляє тест на плазму крові під назвою TauSome. Цей тест виявляє білок тау, пов'язаний з EVs, для діагностики хронічного травматичної енцефалопатії - нейродегенеративного розладу головного мозку, який виникає внаслідок повторних травм голови.
В попередньому клінічному дослідженні тест виявив підвищені рівні білка тау у колишніх гравців в Національній футбольній лізі США порівняно з атлетами, які займалися не контактними видами спорту.
Крім того, EVs мають іншу цікаву властивість, яка робить їх привабливими для діагностики. Оскільки екзосоми часто містять генетичний матеріал, вони можуть стати основою для дуже чутливих діагностичних тестів.
Нейрофізіолог Ендрю Гілл з Університету Вікторії в Мельбурні, Австралія, працює над тестами для виявлення нейродегенеративних захворювань, включаючи хворобу Альцгеймера, на основі рівнів мікроРНК в EVs у крові. Окрім потенційного діагностичного значення, такі тести також можуть допомогти дослідникам краще розуміти патогенетичні механізми захворювань.
Ці нові діагностичні тести можуть врятувати життя та покращити якість життя пацієнтів, і вони зараз знаходяться на передньому краї наукового дослідження.









